3月5日下午,总书记在参加十四届全国人大二次会议江苏代表团审议时强调,要牢牢把握高质量发展这个首要任务,因地制宜发展新质生产力。从2023年在地方考察时首次提出,到今年中央政治局首次集体学习又一次聚焦,新质生产力一时间火遍大江南北。什么是新质生产力?从定义来看,新质生产力是由技术革命性突破、生产要素创新性配置、产业深度转型升级而催生的当代先进生产力,它以劳动者、劳动资料、劳动对象及其优化组合的质变为基本内涵,以全要素生产率提升为核心标志。所谓“新”,便是注重新技术与产业的外延,在关键性、颠覆性技术突破中,注重与新一代信息技术、新能源、新材料、先进制造、生物技术等战略性新兴产业,以及人工智能、脑机接口等未来产业创新结合。生物医药产业也将迎来新一轮变革,新质生产力驱动医疗场景变革的同时,面对大环境、监管、市场的多重压力,医疗产业各方都需要“进化式创新”,来重新定义更有价值的产品、服务、运营与价值链生态。
01
国内生物医药产业现存问题与挑战
(一)在美国推动与中国科技“脱钩”的宏观背景下,产业链供应链短期循环不畅与长期调整并存,原有供应链良性协作机制将会打破,产业链供应链自主安全可控受到挑战。当前,国际经济政治格局复杂多变,以美国为首,为确保其生物制药保持持续竞争力和全球领导地位,基于其政治利益诉求,不断抬高技术、贸易与规则门槛,并通过立法等形式,企图推动与中国的科技“脱钩”“断链”,持续打压中国生物医药产业发展潜力。例如在法律层面,美国明确列出生物技术作为美国重点保护发展的关键技术,并制定详细的对华战略路线图。国会要求禁止向中国出口包括高端医疗设备和生物技术在内的核心技术;此外,美国司法部宣布的“China Initiative”计划,对于中美之间的科技创新人才流动和交流的限制产生了重大影响。国内生物医药产业供应链能力的建设尚处于起步期,生物医药领域面临原材料、试剂耗材、科研仪器设备国产供应门类品种少、质量不稳定等困境,对高成本的进口供应呈现高度依赖特征,例如细胞培养基、蛋白纯化填料90%以上依赖进口。表1 我国部分生物医药设备领域卡脖子环节
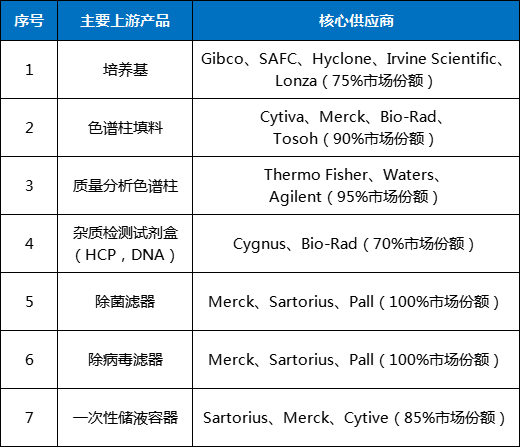
表2 我国部分生物医药上游产品卡脖子环节
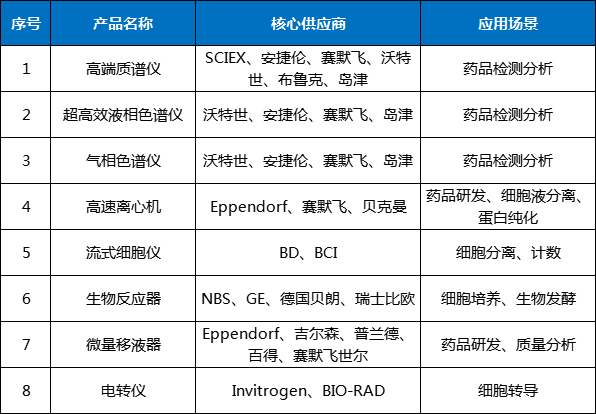
而美国企图推动与中国科技“脱钩”的举动,将会对国内包括生物医药领域在内的产业链供应链构建能力产生进一步影响,进而制约相关基础研究能力与研发创新能力。表3 我国生物医药领域供应链缺乏安全可控的环节
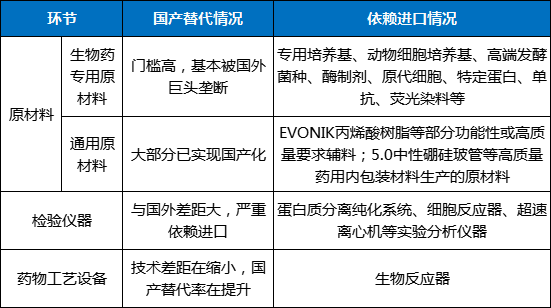
(二)缺乏世界一流的生物医药科创高地,先发区域尚未形成协同发展的良性格局,后发区域存在重复建设、争夺资源的挑战。尽管长三角生物医药产业集群具备代表国家参与世界竞争的发展基础,但是长三角区域仍然缺乏诸如大波士顿地区、以色列、日本东京等全球一流的生物医药科创高地。作为国内一流生物医药产业集聚区,长三角生物医药产业在关键核心零部件和相关配套方面,尚未形成合理分工与协作。另外,作为长三角生物医药产业集群的核心引领区,上海尚未在重点产业领域、关键核心环节,充分发挥创新策源和高端引领功能,反而在产业扶持政策上呈现市内循环的导向。到目前为止,我国生物医药产业园区或涵盖生物医药产业的园区已超过2000个,随着国内各省相继提出生物医药产业发展目标,并强化“一把手”责任,打造产业集群,进一步推动各类生物医药园区如雨后春笋般涌现,尤其是对于产业无基础、区位无优势、人才无吸引力的后发区域来说,出现园区重复建设的现象,同时,部分园区建设呈现“圈一片地,建几栋楼,拉一批企业入驻”的发展特征,从最开始的粗放式企业引入模式到如今的不惜重金招引重点企业模式,园区发展出现资源争夺及恶意竞争现象。(三)企业研发投入严重不足,制约产业发展后劲和潜力。在全球药企研发费用Top10的榜单中,中国药企一直榜上无名,与全球前端药企研发投入相比差距甚远。从细分领域上看,相较药品,作为国内市场远未被满足的医疗器械领域来说,虽然中国医疗器械年复合增长率高达20%,远高于全球平均增速,但是企业研发投入依然严重不足,目前国内在研药品尚未改变跟随创新的格局,越来越多的药企选择通过license in模式补充研发管线。(四)产学研医协同链条尚未根本打通,科技成果转化“最后一公里”建设依然存在梗阻。近年来,在国家持续推动科技创新体制机制建设的战略部署下,生物医药领域的科研机构与企业实现协同研发,并成功孵化转化一批高质量发展企业。但是在高价值成果供给、专业服务体系搭建、科技激励政策创新及执行等层面,仍然存在卡点未清除、转化土壤不够肥沃等难点与痛点,从而导致生物医药领域的科创资源潜力得不到充分发挥、科创资源创新活力得不到有效激发。目前,在以国家全面深化改革为核心的全面创新改革试验文件精神指导下,国内医药类高等院校、科研院所、新型研发机构等各类试点单位,通过探索解决科研人员“不想转”“不敢转”的问题,已逐步成为科技成果转化的主要力量,但是非试点科研事业单位仍然存在职务科技成果权属、作价投资过程中国有股权管理不明晰以及国有资产处置易触红线等问题,科研人员对医药类成果转化仍存顾虑。此外,作为生物医药重要的创新源头之一,临床医生能够发现临床需求,提供产品设计策源。但是国内临床机构大多未建立医学转化平台,缺少临床医生、科学家、企业研发团队“零距离接触”平台,同时,在事业单位职称审评、绩效考核等制度之下,医生更注重科技成果的产生而对成果的转移转化并未重视。因此,和以色列医疗器械专利发明者大多为临床医生的发展成绩相比,国内临床研究成果转化之路任重道远。
站位结构转型升级前沿,实施“提质增效”工程,形成具备国际竞争力的高质量产业体系。围绕五点实施“提质增效”工程,一是创新药“突破计划”,以重大疾病为核心,加大对医药技术研发突破,培育大品种和新品种。二是“首仿药“支持计划”,以临床应用为导向,引导高端仿制药研发生产,支持生物类似药、具有较高临床价值的药械组合产品。三是高端器械“自主计划”,以国产替代为目标,鼓励掌握核心技术的创新产品产业化,推动一批重点医疗器械升级换代和质量性能提升。四是中药创新“传承计划”,以质量标准为根本,形成更加规范化、标准化的产品体系,延伸中医药内涵,扩大品牌中药的产品衍生。五是BT-IT发展“融合计划”,以创新应用为特征,发挥新一代信息产业优势与渗透力,培育医疗健康大数据、智慧医疗等健康新业态。未来在集中带量采购常态化的背景下,可以进一步细化集采评估考量细则,研究微创新采购政策,鼓励相关企业加强质量把控,加大产品创新力度,促使行业健康有序发展。持续推进医保改革,提升医疗服务水平。第一,加大医保资金对互联网医疗的支持力度。针对民众对互联网诊疗需求的提升,进一步降低互联网医疗机构准入门槛,扩大其医保支付范围,加快探索将符合条件的“互联网”医疗服务纳入保障范围。鼓励各地政府探索“互联网”医疗服务,优先在省级层面打通互联网诊疗服务医保线上报销渠道。基于国家放开网售处方药前提,进一步完善网售处方药监管体系,并探索将网售处方药纳入医保支付范围。第二,推进更多罕见病药物加快纳入医保、集采。结合临床治疗用药需求、医保筹资能力等因素,加快将疗效确切、医保基金能够承担的罕见病药物纳入医保支付范围,进一步提升罕见病患者保障水平。积极探索“孤儿药”、短缺药的采购机制,指导地方针对非过评药品及生物制剂等纳入集采。依托各省采购平台加强供需对接,推动“孤儿药”保供稳价。第三,进一步降低药品流通成本。在三明市、泰州市等城市探索“一票制”基础上,加大政策研究,在全国推广“一票制”,鼓励药品生产企业与公立医疗机构之间直接结算药品货款,促进药品经营行业集中度进一步提升。支持全国各省份优先实施医疗耗材“一票制”,并逐步向药品推广。鼓励医药经销商转变业务模式,由医药耗材代理销售转型配送服务。进一步推动药物拓展性临床试验,加速细胞基因商业化进程。目前国家对于药物拓展性临床试验尚未正式出台相应具体规定,参考国际经验,有必要完善该项政策以加速产业化进程。加强供给侧与需求侧的规范建设,逐步构建国际竞争的优势。对于国内原料药企业,参与国际竞争的关键在于积累技术优势,建设专业团队,在规模达到一定程度后注重研发投入,构建技术壁垒;对于重点布局原料药产业的区域而言,需要结合自身特点构建要素平台,关键是创新服务平台和进出口服务平台,以降低企业的研发创新成本,加速创新成果转化,以及提供DMF/CEP申报辅导、进出口便利服务等。加快推进关键共性技术攻关,助力提升生物医药创新竞争力。针对基础研究环节薄弱等痛点问题,依托国内知名高校、科研机构集聚全球顶尖科学团队在合成生物学、脑科学、生物医学大数据等领域加快建设重大科技基础设施,引领原始技术创新突破。继续大力支持高端医疗影像、新型体外诊断产品、新靶点化学药、抗体药物、基因药物、细胞产品、多肽药物及酶工程等关键零部件研制和关键“卡脖子”技术攻关。大力提升公共创新服务平台功能,优化生物医药创新服务生态。优化提升具有共性需求的公共技术服务平台,如新药靶点发现和药物筛选平台、药物评价平台、实验动物中心、医疗器械检验检测等,为创新企业提供全流程关键技术服务。积极搭建政府、企业、医疗机构、高校、科研院所等沟通合作平台,推进“政产学研医”协同创新。积极发挥龙头企业创新主体作用,补齐生物医药创新服务短板。加快培育引进行业龙头合同研发机构(CRO)、合同外包生产机构(CMO)、合同定制研发生产机构(CDMO)等生物医药产业应用基础平台。鼓励龙头企业向平台化和一体化发展,支持其构建各类服务型平台,实现产业链数据、信息和资源的汇聚,形成发展内循环,并通过产业链以商招商服务于本地产业生态,提升地方服务率。同时,加强医药服务产业纵向整合,推进商业模式迭代创新。随着药品研发难度的加大,推进“激励性付费”商业模式,设置最终期限,使得CRO平台公司提前完成项目可获得超额奖金,若推迟完成则收益降低。同时,探索创新型合作模式,逐渐向长期战略合作转变,采用风险共担、利益共享的合作研发模式,药企将项目交付给CXO公司,CXO公司负责项目设计和实施,为药企提供资金、技术等方面的支持,主动承担风险并获得药品上市后的销售分成,一方面降低了药企的研发成本与失败风险,另一方面则使得CXO企业深度参与药物研发,在与药企紧密合作过程中,其主动性和推动作用进一步凸显。发展“AI+新药研发”,提升新药研发的效率,加速我国医药创新升级。一是要突破新技术和新算法,引导技术创新以及AI技术在新药研发各个环节的深入应用;二是建立“AI+新药研发”领域复合人才跨学科培养输出机制,自主培养一批高学识、高能力的“AI+新药研发”领域的科研人员、技术工作者和应用开拓者,加快形成满足行业发展需求的人才网络;三是集中大数据力量助力攻关重大疾病致病机制、药物靶点/表型/分子分型研究,完善医药研发数据库,为拓展AI在新药研发领域的应用构建高质量数据支撑体系;四是强化创制体制设计,建立支撑保障措施包括及时建立监管机制,明晰产权结构,注重保护新药研发中数据资产安全和知识产权。破解数字经济落地路径,推进生物医药数字创新服务平台建设。产业主管部门创新机制,深入推进“双创”,推进地区生物医药数字创新服务平台建设,在产业链各个环节深入推进“双创”,促进生物医药研发产业发展,使研发服务等各项资源能够有效提供、精准匹配、高效协同。路径方面,各地区建设生物医药线上线下一体协同的创新服务平台,线上工作主要是知识图谱构建、大数据中台、企业数字画像构建、企业应用服务场景搭建,线下工作主要是创新服务实体空间建设,整合全球及全国的优质资源供应链服务商、专业技术服务商,运用“平台+运营”的模式,汇聚优质上游供应链资源、实现区域服务资源集聚,无缝、精准地向下游中小企业提供从研发到上市全生命周期各类安全可控、质优价稳的产品和技术服务。平台将有效管理创新资源,帮助国内创新型企业便捷获取发展资源,突破技术瓶颈,为创新发展提供新引擎。鼓励药品医疗器械领域的顶尖人才、海外人才及团队创办企业。提升国内药品医疗器械研发水平,按照相关政策给予资金支持。积极推荐相关人才参选国家及省市人才计划,对入选人才计划并符合相关条件的,在人才引进、职称评审等方面给予积极支持,并鼓励各区在人才公租房、子女入学等方面给予优先支持。优化人才服务保障。面向产业创新发展需求,大力吸引和集聚生物医药领域高端人才,精准实施各类人才计划,大力培养基础研究、产业技术、资本投资、市场营销、园区运营等各类专业人才,为产业人才创新创业提供必要的条件和良好环境。完善人才培养体系。支持高校和科研机构加强生物医药学科建设,对符合条件的高校和职业技术院校根据产业发展需要调整生物医药学院(系、专业)设置,给予一定资金资助。对生物医药企业(机构)与符合条件的高校、职业技术院校、技工院校、医疗机构合作开展人才培养给予一定资金资助。推进生物医药供应链自主安全可控,全面融入国际标准。加快推动创新研发、临床运营及项目管理、市场合作、销售队伍建设等多个环节联动的全球化资源配置,持续推进与海外创新型企业、跨国龙头药企的双向合作,加强licence-in和licence-out两种模式的同步开展,使国内药企融入更高水平的全球化产业生态圈层。加快热门靶点新药、AI影像等新兴业态、特色原料药等领域的国际化商业进程,有效应对部分发达国家“对华”全面竞争限制的升级,针对海外技术引进、科技交流、对外投资、原料药、生物技术开发、疫苗等领域的出口管制等挑战,增强产业链供应链自主安全可控,全面融入国际审评审批标准,促进国内创新型企业融入国际化。声明:本文观点仅代表作者本人,不代表药智产业观察立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间删除。


